Diagnostic et traitement du paludisme
Un diagnostic rapide et précis est essentiel à la gestion efficace du paludisme. Une infection palustre peut être détectée par des diagnostics cliniques ou des diagnostics de laboratoire, mais en raison de la nature non spécifique des signes et symptômes du paludisme, il est conseillé de combiner les deux types de tests de diagnostic (Tangpukdee et al., 2009).
Le diagnostic clinique du paludisme repose sur les signes et symptômes des patients ainsi que sur les constatations physiques lors de l’examen. En laboratoire, le paludisme est diagnostiqué à l’aide de différentes techniques.
La référence en matière de diagnostic en laboratoire est l’examen microscopique des frottis sanguins colorés à l’aide des colorations de Giemsa, de Wright ou de Field (Warhurst and Williams, 1996; Bharti et al., 2007).
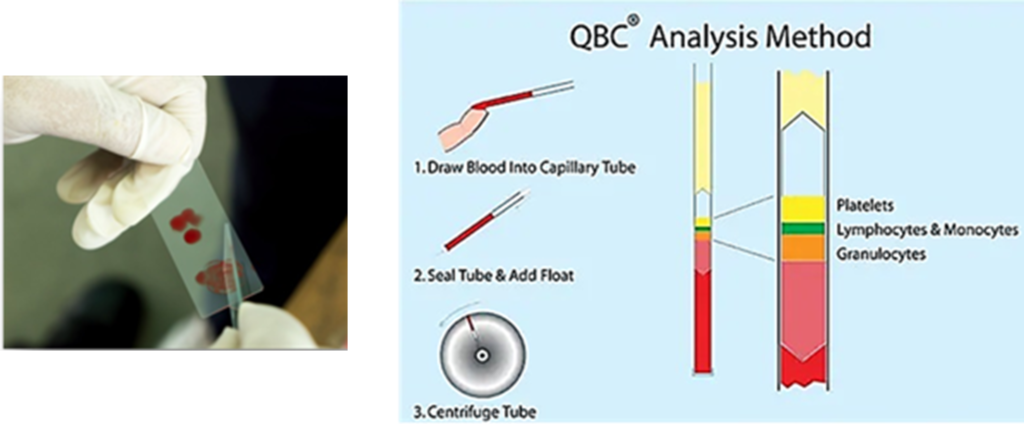
Une autre technique, la QBC technique, permet de colorer le Plasmodium génome dans des tubes à microhématocrite avec des colorants fluorescents, tels que l'acridine orange, et de le détecter ensuite par microscopie épifluorescente. Les noyaux du parasite apparaissent en vert vif, au lieu du cytoplasme jaune-orange (Chotivanich et al., 2006).
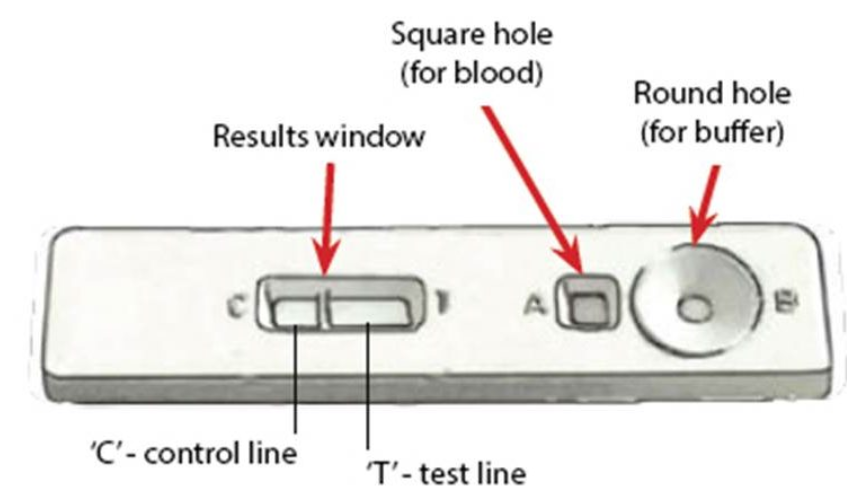
Des tests rapides pour le diagnostic du paludisme (RTD) sont également disponibles, par ex. OptiMAL (Tagbor et al., 2008; Zerpa et al., 2008), ICT (Ratsimbasoa et al., 2008), Para-HIT-f (McMorrow et al., 2008), ParaScreen (Endeshaw et al., 2008), SD Bioline (Lee et al., 2008), Paracheck (Harvey et al., 2008). Les TDR sont tous basés sur le même principe et détectent l'antigène du paludisme (une P. falciparumprotéine spécifique, par exemple la protéine II riche en histidine, la lactate déshydrogénase, l'aldolase, etc.) dans le sang circulant le long d'une membrane contenant des anticorps spécifiques antipaludiques.
Des techniques de diagnostic du paludisme basées sur l'analyse moléculaire ont été récemment développées. Ils affichent une sensibilité et une spécificité plus élevées par rapport aux techniques de diagnostic traditionnelles. Les plus courantes sont les techniques de test PCR, d'amplification isotherme à médiation en boucle (LAMP), de puces à ADN, de spectrométrie de masse (MS) et de cytométrie en flux (FCM).
Concernant le FCM, le principe de cette technique repose sur la détection de l'hémozoïne, qui est produite lorsque les parasites intra-érythrocytaires du paludisme digèrent l'hémoglobine de l'hôte et cristallisent l'hème toxique libéré en hémozoïne dans la vacuole acide. L'hémozoïne dans les phagocytoses peut être détectée par dépolarisation de la lumière laser, lorsque les cellules traversent un canal de cytomètre en flux (Wongchotigul et al., 2004; Shapiro and Mandy, 2007; Izumiyama et al., 2009)
Une fois le diagnostic de paludisme posé, un traitement antipaludique approprié doit être instauré immédiatement.
Le traitement du paludisme dépend de nombreux facteurs, notamment:
- L'espèce de parasite du paludisme à l'origine de la maladie ;
- État clinique du patient;
- Sensibilité attendue aux médicaments du parasite infectant, déterminée par la zone géographique où l'infection s'est développée;
- Utilisation antérieure d'antipaludiques, y compris ceux pris pour la chimioprophylaxie du paludisme.
Les médicaments antipaludiques les plus courants comprennent:
- Phosphate de chloroquine. Le phosphate de chloroquine est le traitement préféré si l'infection est considérée comme simple et est causée par un parasite de l'espèce P. falciparum sensible au médicament. Il se concentre dans les vésicules acides du parasite, augmentant le pH interne et inhibant ainsi la croissance du parasite (Naß and Efferth, 2018; Pinheiro et al., 2018).
- Hydroxychloroquine. L'hydroxychloroquine est également un traitement de première intention acceptable contre P. falciparum sensible à la chloroquine et possède un mécanisme d'action similaire à celui du phosphate de chloroquine (Naß et Efferth, 2018 ; Pinheiro et al., 2018).
- Phosphate de primaquine. Le phosphate de primaquine est ajouté au phosphate de chloroquine ou à l'hydroxychloroquine lorsque les infections sont causées par P. vivax ou P. ovale avec une sensibilité à la chloroquine. Ce médicament agit en éliminant le parasite qui reste dormant dans le foie du patient (Karunajeewa et James, 2020).
- Atovaquone-proguanil. L'atovaquone-proguanil est utilisé dans le traitement des infections causées par P. falciparum résistantes à la chloroquine. L'atovaquone inhibe sélectivement le transport d'électrons mitochondriaux du parasite et le proguanil inhibe la dihydrofolate réductase, perturbant la synthèse du désoxythymidylate (Hill et al., 2022).
- Artemether-lumefantrine. L'artéméther-luméfantrine est une option alternative de première intention pour le traitement du paludisme causé par P. falciparum-résistant à la chloroquine. Le mécanisme d'action consiste à inhiber la synthèse des acides nucléiques et des protéines (Hamaluba et al., 2021).
- Sulfate de quinine plus doxycycline, tétracycline ou clindamycine. Le sulfate de quinine associé à la doxycycline, à la tétracycline ou à la clindamycine est une option de deuxième intention pour traiter le paludisme causé par P. falciparum-résistant à la chloroquine. La quinine s'intercale dans l'ADN, perturbant la réplication et la transcription des parasites (Hill et al., 2022).
- Gluconate de quinidine. Le gluconate de quinidine est le médicament de choix contre le paludisme grave, car il s'agit du seul médicament antipaludique disponible par voie parentérale (Hill et al., 2022).
Sources:
1. Bharti, A.R., et al. (2007) Polymerase chain reaction detection of Plasmodium vivax and Plasmodium falciparum DNA from stored serum samples: implications for retrospective diagnosis of malaria. Am J Trop Med Hyg. 77, 444-6
2. Chotivanich, K., et al. Laboratory diagnosis of malaria infection-a short review of methods. (2006) Aust J Med Sci. 27, 11-5
3. Endeshaw, T., et al. (2008) Evaluation of light microscopy and rapid diagnostic test for the detection of malaria under operational field conditions: a household survey in Ethiopia. Malar J. 7, 118
4. Hamaluba, M., et al. (2021) Arterolane-piperaquine-mefloquine versus arterolane-piperaquine and artemether-lumefantrine in the treatment of uncomplicated Plasmodium falciparum malaria in Kenyan children: a single-centre, open-label, randomised, non-inferiority trial. Lancet Infect Dis. 21, 1395-1406
5. Harvey, S.A., et al. (2008) Improving community health worker use of malaria rapid diagnostic tests in Zambia: package instructions, job aid and job aid-plus-training. Malar J. 7, 160
6. Hill, S.R., et al. (2022) Antimalarial Medications In: Hill, S.R., Thakur, R.K., Sharma, G.R. Editors: StatPearls. Treasure Island, FL
7. Izumiyama, S., et al. (2009) Plasmodium falciparum: development and validation of a measure of intraerythrocytic growth using SYBR Green I in a flow cytometer. Exp Parasitol. 121, 144-50
8. Karunajeewa, H., James, R. (2020) Primaquine for Plasmodium vivax malaria treatment. Lancet. 395, 1971-2
9. Lee, S.W., et al. (2008) Rapid diagnosis of vivax malaria by the SD Bioline Malaria Antigen test when thrombocytopenia is present. J Clin Microbiol. 46, 939-42
10. McMorrow, M.L., et al. (2008) Challenges in routine implementation and quality control of rapid diagnostic tests for malaria-Rufiji District, Tanzania. Am J Trop Med Hyg. 79, 385-90
11. Naß, J., Efferth, T. (2018) The activity of Artemisia spp. and their constituents against Trypanosomiasis. Phytomedicine. 47, 184-91
12. Pinheiro, L.C.S., et al. (2018) Current Antimalarial Therapies and Advances in the Development of Semi-Synthetic Artemisinin Derivatives. An Acad Bras Cienc. 90, 1251-71
13. Ratsimbasoa, A., et al. (2008) Evaluation of two new immunochromatographic assays for diagnosis of malaria. Am J Trop Med Hyg. 79, 670-2
14. Shapiro, H.M., Mandy, F. (2007) Cytometry in malaria: moving beyond Giemsa. Cytometry A. 71, 643-5
15. Tagbor, H., et al. (2008) Performance of the OptiMAL dipstick in the diagnosis of malaria infection in pregnancy. Ther Clin Risk Manag. 4, 631-6
16. Tangpukdee, N., et al. (2009) Malaria Diagnosis: A Brief Review. Korean J Parasitol. 47, 93-102
17. Warhurst, D.C., Williams, J.E. (1996) Laboratory diagnosis of malaria. J Clin Pathol. 49, 533-8
18. Wongchotigul, V., et al. (2004) The use of flow cytometry as a diagnostic test for malaria parasites. Southeast Asian J Trop Med Public Health. 35, 552-9
19. Zerpa, N., et al. (2008) Evaluation of the OptiMAL test for diagnosis of malaria in Venezuela. Invest Clin. 49, 93-101
· www.cdc.gov
· www.yourgenome.org